锂离子电池正极材料的最新研究——尖晶石型锰酸锂的应用
发表时间: 2022-01-01 23:54
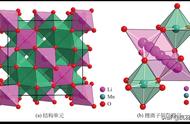
尖晶石型锰酸锂(LiMn₂O₄)属于对称性立方晶系,空间群为Fd₃m,晶胞参数为0.8246nm。在LiMn₂O₄体系中,单位晶格有32个氧原子,氧离子保持面心立方密堆积,锂离子占据64个氧四面体中的8个四面体8a位置,形成近似金刚石的结构,Mn原子重排进入32个氧八面体空隙的16个八面体的16d位置,剩余的16个八面体16c的空位形成立方晶格常数一半的相似的三维(3D)结构八面体。尖晶石型LiMn₂O4中的四面体8a、48f和八面体晶格16c共面而构成互通的三维离子通道,有利于Li+的嵌入和脱出,锂离子沿8a—16c—8a路径直线扩散,8a—16c—8a夹角约为108°,见下图。事实上,LiMn₂O₄的锂离子迁移速率和电导率都较低,分别为10⁻¹¹~10⁻⁹cm²/s和10⁻⁶S/cm,导致倍率性能较差。
尖晶石型锰酸锂结构
LiMn₂O₄中包含的3价和4价的Mn各占50%,锰酸锂的电化学反应可用下式表示:
充电脱锂时,Li⁺从8a脱出,n(Mn³⁺)/n(Mn⁴⁺)比变小,当Mn³⁺全部变为Mn⁴⁺时,形成[Mn₂]₁₆dO₄稳定的尖晶石骨架,发生的反应可用以下式表示:
LiMn₂O₄完全充电脱锂形成λ⁃MnO₂,可能在化学计量不变的情况下发生相变,经ε⁃MnO₂转变成没有活性的β⁃MnO₂,导致容量衰减。
放电嵌锂时,Li⁺嵌入[Mn₂]O₄基体中,优先嵌入8a位置,伴随部分Mn⁴⁺还原为Mn³⁺,但尖晶石的骨架保持不变。尖晶石结构锰酸锂的放电曲线可见下图。嵌锂过程分两步进行:
尖晶石结构锰酸锂(LiMn₂O₄)的放电曲线
① 当x≤0.5时,锂离子先均匀占据每个晶胞一半的8a位置,此时对应开路电压为4.14V。x=0.5附近电压有一个稍微的下降,对应于锂离子在一半的四面体8a位置即将嵌满。也有文献认为放电嵌锂的初期(x<0.5)有两相共存,在x=0.2时存在一个新立方相。
② 当0.5<x≤1时,锂离子嵌入另一半8a位置,此时对应开路电压为4.03V(相对Li⁺/Li)。8a位置占满时,对应的Mn⁴⁺有一半转变为Mn³⁺。
当过放电时,x>1,锂离子进一步嵌入16c位置,这时嵌锂电压由4V变为3V。发生的反应可用下式表示:
根据经典的晶体场理论,Mn⁃O配位八面体的形状取决于Mn中心离子的化合价,当有更多的Mn化合价变为+3时,Mn⁃O配位八面体的形状由立方晶系堆积的氧点阵变为了四方晶系的氧点阵,使得沿c轴方向的Mn—O键长变长,而沿a轴和b轴则变短,晶胞单元的体积增加了6.5%,发生Jahn⁃Teller效应,如下图所示。Jahn⁃Teller效应会导致尖晶石晶格的变化甚至破坏,从而破坏锂离子的三维离子迁移通道,使锂离子的脱出和嵌入难以可逆进行,表现为LiMn₂O₄正极材料容量的衰减。
另外,LiMn₂O₄在充放电过程中,Mn容易发生溶解。这是由于电解液中残留的微量水与含氟磷酸盐(LiPF₆)反应生成HF,导致LiMn₂O₄中Mn³⁺发生歧化反应生成Mn⁴⁺和Mn²⁺,其中Mn⁴⁺则形成MnO₂留在材料中,Mn²⁺进入电解液。
进入电解液的Mn²⁺还可以进一步反应生成MnO并沉积在负极上。从上述方程式上还可以看出,Mn³⁺的歧化反应过程会生成H₂O,而H₂O又会进一步促使HF的产生,这便构成了一个恶性循环。这是一个自催化的反应,而且温度的升高会加剧这一反应。因此尖晶石LiMn₂O₄在高温下容量会快速衰减。
尖晶石结构锰酸锂(LiMn₂O₄)优点是电压高、抗过充性能好、安全性能好、容易制备,同时Mn资源丰富、价格便宜、无毒无污染;缺点是比容量低且可提升空间小,在正常的充放电使用过程中Mn会在电解质中缓慢溶解,深度充放电和高温条件下晶格畸变较为严重,导致循环性能变差。目前LiMn₂O₄主要用于动力锂离子电池。